quinta-feira, 24 de setembro de 2020
domingo, 20 de setembro de 2020
PLANO TUTORADO CIÊNCIAS 6ºVOLUME 04
PLANO
DE ESTUDO TUTORADO
|
COMPONENTE
CURRICULAR: CIÊNCIAS ANO
DE ESCOLARIDADE: 6º ANO NOME DA
ESCOLA: ESCOLA ESTADUAL PROF. FRANCO
DA ROSA ESTUDANTE:____________________________________TURMA: _______ NÚMERO
DE AULAS POR SEMANA: 3 TURNO: VESPERTINO TOTAL
DE SEMANAS: 4 NÚMERO DE AULAS POR MÊS: 12 PROFESSORA: MARIA DE FÁTIMA ASSIS LEPESQUEUR |
UNIDADE(S)
TEMÁTICA(S): Matéria
e Energia.
OBJETOS DE
CONHECIMENTO: Misturas
homogêneas e heterogêneas.
HABILIDADE(S):
(EF06CI22MG) Diferenciar Substância
Pura de Mistura.
(EF06CI01) Classificar como homogênea
ou heterogênea a mistura de dois ou mais materiais (água e sal, água e óleo,
água e areia, etc).
CONTEÚDOS
RELACIONADOS: Classificação
da matéria.
SEMANA 01
AO FINAL DESTA AULA O
ESTUDANTE SERÁ CAPAZ DE:
— Compreender a composição da matéria
em unidades estruturais;
— Analisar esquemas sobre
classificação da matéria;
— Diferenciar e exemplificar
substância pura e mistura;
— Diferenciar e exemplificar mistura
homogênea e heterogênea.
— Desenvolvendo o tema: MATÉRIA, UNIDADES ESTRUTURAIS, CLASSIFICAÇÃO
Vocês aprenderam que a matéria
é tudo aquilo que tem massa e ocupa lugar no espaço. Mas de que a matéria é
formada? Ao nível submicroscópico, a matéria consiste de unidades
estruturais ou partículas bem pequenas: os átomos e moléculas. Um átomo
é a menor unidade estrutural da matéria que conserva todas as propriedades
de um elemento químico. Segundo o cientista inglês John Dalton (1808), que
propôs primeiro modelo atômico, o átomo seria uma esfera maciça (Fig.1),
indivisível e indestrutível, podendo ser representada por uma bola de
bilhar/sinuca.
Figura 01: Esfera maciça, segundo Dalton
Vamos basear no modelo de Dalton para representar as unidades estruturais. O nosso corpo é formado por por vários elementos químicos (grupo de átomos iguais) que vocês já devem ter ouvido falar: Ferro, hidrogênio, Carbono, Oxigênio, Nitrogênio, dentre outros. Podemos, então, representá-los por bolinhas diferentes:
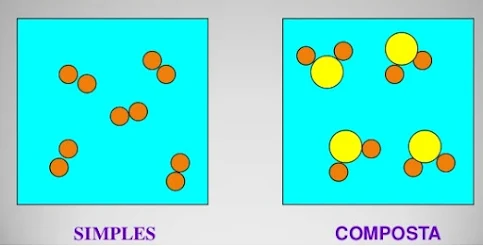
Os átomos
combinam-se formando as moléculas (Fig.2) que podem ser simples (átomos iguais)
ou compostas (átomos diferentes). No caso da água, representada quimicamente
pela molécula de H2 O , temos dois átomos de hidrogênio e um átomo de carbono.
Figura 02: Representação de unidades estruturais: moléculas simples e compostas
Obs: Acima vemos 3 unidades estruturais diferentes, portanto, 3 substâncias diferentes!!!
|
A matéria pode ser classificada em substância pura ou mistura. |
Para
sabermos se uma substância é pura (Fig.3) devemos fazer uma análise
química de sua composição. A olho nu não podemos afirmar com certeza esta
classificação, por isso a importância de conhecer as unidades estruturais.
Observe o frasco na imagem ao lado, ele contém uma matéria formada pelas mesmas
unidade estruturais (moléculas formadas por duas bolinhas da mesma cor), portanto,
uma substância pura! São exemplos de substâncias puras: a água destilada (muito
usada em laboratório e na produção de medicamentos), o oxigênio puro e o
diamante. Uma substância pura possui composição química e propriedades químicas
e físicas constantes, tais como densidade, temperatura de ebulição e fusão.
Enquanto a água ferve, a temperatura permanece em torno de 100 ºC até finalizar
a ebulição, o mesmo ocorre no derretimento do gelo, cuja temperatura permanece
em 0 ºC até formar todo o líquido.
Fig. 03 Substância pura Fig. 04 Substância composta

Fig.05 Mistura
No dia a dia, podemos observar vários tipos de misturas: o café, o leite, o refrigerante, o suco de laranja, o shampoo, o petróleo, a areia, dentre diversas outras. Muitas misturas possuem apenas uma fase, isto é, uma porção uniforme, sendo denominadas de misturas homogêneas
Toda mistura
homogênea é denominada solução. Um exemplo bem comum é a solução alcoólica,
muito utilizada no combate ao coronavírus.
O álcool
etílico 70% é um exemplo de mistura homogênea ou simplesmente solução. Há
diversos outros exemplos em nossa casa, dentre eles, podemos citar a água
sanitária e o vinagre . Mas, outras possuem duas ou mais fases , são as misturas
heterogêneas .
Fonte:
Química na Abordagem do Cotidiano - vol. I
Figura 06: Misturas Homogêneas e Misturas Heterogêneas
ATIVIDADES SEMANA 01
Responda às questões:
1 — Liste três misturas homogêneas e três misturas heterogêneas que você conhece, com base nos conhecimentos científicos estudados. Em seguida, indique quantas fases cada uma das misturas heterogêneas apresentam.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2 — A água dita potável, que é filtrada ou vem de uma nascente, possui diversos sais minerais dissolvidos.Neste caso, a água pode ser classificada como uma substância pura ou uma solução?
Justifique sua resposta.
3 — Como você
classificaria o ar atmosférico? Pesquise os componentes do ar, desenhe um
esquema usando bolinhas para representar os gases que o compõe. Não esqueça da
legenda!
4 — Esquematize
por meio de um desenho um copo com água, areia e óleo, indicando as fases da
mistura.
|
|
5 — Quantas
unidades estruturais (moléculas) estão contidas no frasco ao lado?
A substância é pura? Justifique.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
|
REFERÊNCIAS PERUZZO.
F.M.; CANTO. E.L., QUÍMICA NA ABORDAGEM DO COTIDIANO - VOLUME 1. 5ª
Edição. Ed Moderna,
São Paulo, 2009. CARNAVALLE,
Maria Rosa. ARARIBÁ MAIS CIÊNCIAS — 6º Ano. 1ª Edição. São Paulo:
Editora Moderna, 2018. NERY,
A. L. P.; CATANI, A.; AGUILAR, J. B. GERAÇÃO ALPHA CIÊNCIAS — 6º Ano.
2ª Edição. São Paulo:
SM Editora, 2018. Representação
de átomos, moléculas e substância segundo Dalton. Disponível
em”https://mundoeducacao. uol.com.br/quimica/representacao-atomos-moleculas-substancias-segundo-dalton. htm.
Acesso em: 30 jul. 2020. Matéria,
átomos e elementos. Disponível em:
https://pt.khanacademy.org/science/biology/chemistry-- of-life/elements-and-atoms/a/matter-elements-atoms-article.
Acesso em: 30 jul. 2020. SAIBA
MAIS… Você
poderá aprofundar seus conhecimentos buscando outras fontes de informações: |
SEMANA 02
SEMANA 2
AO FINAL
DESTA AULA O ESTUDANTE SERÁ CAPAZ DE:
|
Compreender
os diferentes métodos de separação de misturas homogêneas; Selecionar
corretamente os métodos mais adequados para separar cada tipo de mistura.
|
Desenvolvendo
o tema: MÉTODOS DE SEPARAÇÃO DE MISTURA
A maioria dos materiais
existentes na natureza encontra-se sob a forma de mistura homogênea ou heterogênea.
Para que o homem pudesse utilizá-las, foi necessário criar métodos para separar
diversas substâncias, tais como: o sal de cozinha da água do mar, os
componentes do petróleo, as impurezas da água contaminada, etc.
Para separar as
substâncias presentes em uma mistura é preciso conhecer as características
físicas e químicas das mesmas, como composição, densidade, tamanho e
solubilidade dos componentes sólidos (capacidade de ser dissolvido pela água),
temperatura de fusão e ebulição, quantidade de fases presentes na mistura,
dentre outras.
Métodos
de separação de misturas homogêneas
Em uma mistura homogênea
temos dois componentes: o soluto (substâncias que podem se dissolver) e
o solvente (substância que dissolve o soluto). A água é considerada o solvente
universal, pois dissolve a maioria das substâncias. Como exemplo de mistura
homogênea temos a água com açúcar
(Fig. 1). Neste sistema,
os cristais de açúcar representam o soluto e a água, o solvente.
Fonte: Química: Físico-química - vol. II
Figura 01: Solução de açúcar em AGUA
Vaporização
ou evaporação: Consiste em deixar a água da mistura (o solvente)
evaporar pelo calor do sol, separando-a do soluto. Esse processo é utilizado nas salinas para separar o sal da água do mar. No processo de evaporação, o líquido se perde para a atmosfera, mas se quisermos obter o líquido novamente precisamos de utilizar um outro processo mais sofisticado: a destilação.
Destilação simples: A destilação simples é usada para separar componentes de uma mistura de um líquido e um sólido dissolvido, como a mistura de água e sal. . No processo de destilação simples usa-se um aparelho chamado destilador (Fig.2). A substância que entrar em ebulição primeiro produzirá vapor que passará por um tubo (condensador) resfriado externamente por uma corrente de água fria. O vapor se condensa, volta ao estado líquido e escorre até ser recolhido em um frasco. A outra substância fica no recipiente da fervura.
Destilação
fracionada
Método
utilizado para separar mistura homogênea de líquidos com temperaturas de
ebulição próximas.
A solução é aquecida e separa-se, inicialmente, o líquido com menor temperatura de ebulição e assim, sucessivamente, até a separação do líquido com maior temperatura de ebulição.
O petróleo, extraído do subsolo, é um líquido formado por uma mistura de várias substâncias que são separadas nas refinarias pela destilação fracionada (Fig.3). O petróleo é uma fonte de substâncias conhecidas como hidrocarbonetos, ou seja, substâncias que apresentam carbono e hidrogênio em sua composição. Para a sua separação, o petróleo é aquecido, vaporiza-se e sobe por uma torre. Em cada nível da torre, condensa-se uma fração do petróleo de acordo com a sua temperatura de ebulição e o líquido é recolhido resultando em vários produtos (gasolina, querosene, óleo diesel e gás de cozinha).
ATIVIDADES SEMANA 02 pags
33/34
1. Qual a importância dos métodos de separação para a sociedade?
_________________________________________________________________
__________________________________________________________________
__________________________________________________________________
2. Por que a água é denominada solvente universal?
_________________________________________________________________
__________________________________________________________________
__________________________________________________________________
3. Cite uma vantagem da destilação
simples em relação à evaporação na separação de mistura
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
4 — Você
conheceu neste capítulo alguns métodos para separar misturas. Agora, indique os
métodos que podem se aplicar em cada caso.
a) Álcool
e água
____________________________________________________________
b) Água e
sal_________________________________________________
c) Petróleo___________________________________________________
5 — Um dos
métodos de separação do sal de cozinha da água do mar é feito em salinas,
comuns em diversos estados da Região Nordeste. A água do mar é colocada em
grandes recipientes, de pequena profundidade, construídos na areia. Com a ajuda
do Sol e dos ventos que são intensos nestas regiões, ocorre um processo físico
de separação em que o sal de cozinha e outros componentes sólidos vão se
depositando no fundo dos tanques.
Com base no texto acima,
responda:
a) Qual é o nome do processo físico que auxilia na separação do sal de
cozinha e a água?__________________________________________
b) Quais são os pré-requisitos necessários da região para que o sal possa ser separado?_______________________________________________________
c) Que outro método pode
ser utilizado para a separação sal-água nestes casos?
________________________________________________________________
|
REFERÊNCIAS GEWANDSZNAJDER,
Fernando; PACCA, Helena. Teláris Ciências 6º ano. 3. ed. São Paulo : Ática, 2019.
P. 196 — 208. PERUZZO.
F.M.; CANTO. E.L., QUÍMICA NA ABORDAGEM DO COTIDIANO - VOLUME 1. 5ª
Edição. Ed Moderna,
São Paulo, 2009. FELTRE,
Ricardo. QUÍMICA: FÍSICO-QUÍMICA - VOLUME 2. 7ª Edição.São Paulo:
Moderna, 2008. NERY,
A. L. P.; CATANI, A.; AGUILAR, J. B. GERAÇÃO ALPHA CIÊNCIAS — 6º Ano.
2ª Edição. São Paulo:
SM Editora, 2018. https://www.manualdaquimica.com/quimica-geral/metodos-separacao-misturas.htm https://www.todamateria.com.br/separacao-de-misturas/ SAIBA
MAIS... Assista ao vídeo
sobre a destilação do petróleo disponível em: https://youtu.be/QahPYE8Kddw
|
SEMANA 03
AO FINAL DESTA AULA O ESTUDANTE SERÁ CAPAZ DE:
—
Compreender os diferentes métodos de separação de misturas heterogêneas;
— Selecionar corretamente os métodos mais adequados para separar cada tipo de mistura;
— Identificar métodos de separação de misturas utilizados em seu dia a dia.
Desenvolvimento do tema: SEPARAÇÃO DE MISTURAS HETEROGÊNEAS
Decantação: Método utilizado para separar uma mistura através
da diferença de densidade.
A mistura de água e areia em um
frasco pode ser separada dessa forma, pois se deixarmos o material descansar, a
fração mais densa (areia) fica no fundo do recipiente, isto é, decanta, e a
mais leve (água) fica acima. Em seguida pode-se usar um sifão para transferir a
água para outro frasco. A decantação (Fig. 1) é um dos métodos utilizados nas
estações de tratamento de água.
Podemos separar diferentes líquidos com densidades diferentes, como água e óleo usando o funil de decantação (Fig.2). Após a decantação, abre-se a torneira para o líquido mais denso descer para outro recipiente.
Figura 1. Tanque de decantação em estação de Fig. 2 Funil de decantação
tratamento da água
Catação: É um
método simples de separação de mistura heterogênea de componentes sólidos
utilizando as mãos ou pinça. Na triagem de resíduos sólidos, a catação é
essencial para a separação de papéis, plásticos, metais, etc. Esse método
também é utilizado na cozinha para a catação de pedras e impurezas no feijão.
Peneiração: Método
muito utilizado por pedreiros nas construções. Usa-se a peneira para separar a
areia fina da areia grossa, das pedras e de outros componentes de tamanhos
diferentes.
Dissolução fracionada (Fig 3) é um método utilizado quando apenas um dos componentes da mistura heterogênea é solúvel em água. Podemos exemplificar com a mistura de areia e sal, pois apenas o sal dissolve na água.
Após a dissolução, a mistura deve passar por outro método de separação, como a filtração ou a destilação.
Filtração: é um processo utilizado para separar mistura sólido-líquido , em que o sólido é insolúvel em água ou outro solvente.
Fig..3 Dissolução
Podemos exemplificar com a coação de café usando um filtro de papel ou tecido (Fig 4)
Outro exemplo é o filtro de barro utilizado nas
residências para filtrar a água da torneira antes de bebê-la.
A vela do filtro retém as partículas maiores (como partículas de solo ou certos microrganismos) e deixa passar a água com sais minerais e outras partículas muito pequenas. No laboratório de pesquisa, esse método é muito utilizado para filtrar impurezas (Fig. 5)
Fig.
5
Filtração de café Fig. 6
Filtração em laboratório
ATIVIDADES SEMANA 03
Responda às
questões:
1 — Leia o texto a seguir e responda as questões no
caderno.
O petróleo é formado por uma mistura complexa de componentes, porém não existe nenhum método capaz de separar cada um desses componentes. Por isso, essa separação ocorre em frações, ou seja, uma mistura complexa é separada em misturas mais simples, formadas por menos componentes.
Na imagem a seguir, está representado o processo de separação do petróleo em misturas com número de componentes.
a) Dê o
nome do processo de separação de misturas pelo qual são obtidas as frações do petróleo
e o nome da propriedade específica das substâncias na qual se baseia esse processo.
________________________________________________________________
b) O
petróleo, ao ser extraído, está repleto de impurezas como água salgada, areia,
argila e pedaços de rochas. Sabendo que a água salgada é mais densa que o
petróleo, proponha métodos para separar o petróleo de suas impurezas.
_______________________________________________________________
2. Indique
o número de fases das seguintes misturas:
a) água, óleo e
areia:_____________________________________________
b) água e sal (com excesso de sal no fundo):
___________________________
c) água com gás: __________________________________________________
3.Represente dentro do frasco ao lado a mistura de água, óleo e areia, mostrando suas fases com setas.
4 .Um hábito ainda muito comum nas cozinhas
brasileiras é o de escolher feijão. Pequenas sujeiras, como grãos que não se
desenvolveram, restos de solo e pedaços de cascas de feijão precisavam ser
retirados antes do cozimento. Responda como é conhecido esse processo de
separação de misturas e justifique a sua resposta.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
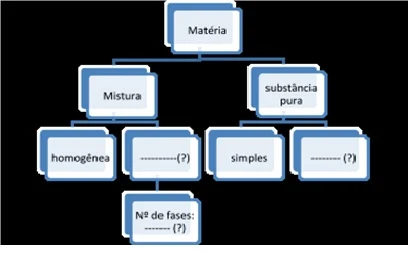
5.
Complete o mapa
de ideias com o resumo da matéria estudada:
Qualquer duvida confira a imagem na pag 148 do seu livro.
|
REFERÊNCIAS GEWANDSZNAJDER, Fernando; PACCA,
Helena. Teláris
Ciências 6º ano. 3. ed. São
Paulo : Ática, 2019. P. 196 — 208. NERY, A. L. P.; CATANI, A.;
AGUILAR, J. B. GERAÇÃO ALPHA
CIÊNCIAS — 6º Ano. 2ª Edição.
São Paulo: SM Editora, 2018. Métodos de Separação de Misturas.
Disponível em: https://www.manualdaquimica.com/quimica- geral/metodos-separacao-misturas.htm.
Acesso em: 30 jul. 2020. SAIBA MAIS… Assista ao vídeo “separação de misturas” disponível em : https://youtu.be/HvvmwLPVBuc |
ATIVIDADES SEMANA 04
AO FINAL DESTA AULA O ESTUDANTE SERÁ CAPAZ DE:
—
Compreender as diferenças entre as transformações químicas e as transformações
físicas;
—
Identificar evidências de transformações químicas;
—
Compreender a importância das transformações químicas para a humanidade.
Desenvolvendo o tema:
"Na natureza nada se cria, nada se perde, tudo se transforma”, já dizia o cientista Antoine-Laurentde Lavoisier...
Observamos diversas transformações químicas no nosso cotidiano: nas folhas secas que se decompõem no jardim, no cozimento de alimentos na cozinha, na digestão dos alimentos no nosso organismo, na produção de gás carbônico pela queima de combustível nos automóveis, no enferrujamento de um prego, dentre tantas outras. Em uma transformação química ou reação química ocorre rearranjo das unidades estruturais da matéria, alteração de sua composição, de suas propriedades específicas e formação de novas substâncias. Se acendermos uma lâmpada e apagarmos depois, percebemos que sua estrutura não altera, pois houve apenas uma transformação física. Mas, se queimarmos uma vela (Fig.1), por exemplo, são produzidas novas substâncias, caracterizando uma transformação química.

Fig. 1 Queima de vela
|
Combustão da vela A vela é feita de parafina usada para iluminar. A cera de parafina é um hidrocarboneto pesado que vem do óleo cru. Quando você acende uma vela você derrete a cera dentro e próxima ao pavio. O pavio absorve a cera líquida e puxa-a para cima. O calor da chama vaporiza a cera, e é o vapor da cera que se queima. A razão pela qual o pavio não se queima é porque a cera vaporizada refrigera o pavio exposto e o protege. Disponível em http://www.quimica.seed.pr.gov.br/modules/galeria/detalhe.php?foto=1333&evento=3. Acesso 23 jul. 2020. |
Você
pode se perguntar: Na combustão da vela, que substâncias novas se formam? A
queima da parafina, em presença de oxigênio, produz gás carbônico, vapor d’água
ocorrendo a liberação de energia.
Mas,
podemos representar a reação química por um equação em que temos os reagentes,
substâncias iniciais que se combinam e os produtos, as novas substâncias produzidas. Veja o exemplo:
|
Reagentes Produtos |
Evidências de uma reação química
Nem toda reação química é evidente, mas existem pistas que nos mostram a sua ocorrência, são elas:
Produção de calor ou chama: ocorre no processo de combustão.
Mudança de cor — Ex: ocorre em reações químicas que indicam a acidez.
Mudança de odor e/ou textura — Ex: quando alimentos se estragam.
Liberação de gás — por exemplo, ao jogar um
comprimido efervescente na água.
ATIVIDADES SEMANA
04
Leia a receita de bolo de chocolate (que tal pedir o responsável para fazer?) e responda às perguntas que se seguem:
INGREDIENTES
• 1 xícara
(chá) de açúcar
• 2 xícaras
(chá) de farinha de trigo
• 2
colheres (sopa) de margarina
• 3 ovos
• 1 xícara
(chá) de leite
• 1 colher
(sopa) de fermento em pó
• Duas
colheres de cacau em pó
• 100 g de
coco ralado
a) Escreva na tabela os reagentes e o produto da reação:
|
REAGENTES |
PRODUTO |
|
|
|
b) Cite uma evidência que ocorreu uma reação química:
_________________________________________________________________
__________________________________________________________________
Hora da pesquisa!
2 — Você já viu um prego ou outro material enferrujado? Que substância presente no ar reage com o ferro? Que produto é formado?
Hora da Investigação!
O cozimento de um ovo é uma transformação química ou física?
I. Hipótese: A mudança de cheiro, textura e cor são evidências da transformação química do ovo.
II. Materiais: um ovo, uma panela com água, um prato (obs. Peça o responsável para fazer o experimento com você).
III. Procedimentos:
1. Quebrar
um ovo em um prato
2. Observar a aparência da clara e da gema, sentir o odor, sentir a textura com as pontas do dedo.
3. Anotar
as observações no item IV
4. Pedir ao
responsável para cozinhar o ovo
5. Retirar
a casca, partir ao meio
6. Repetir o item 2 e 3
IV. Observações:
V. Conclusão:
(A hipótese
foi confirmada?) Justifique.
|
|
|
REFERÊNCIAS GEWANDSZNAJDER, Fernando; PACCA,
Helena. Teláris Ciências
6º ano. 3. ed. São
Paulo : Ática, 2019. P. 196 — 208. https://www.educamaisbrasil.com.br/enem/quimica/transformacoes-quimicas https://novaescola.org.br/conteudo/2076/as-transformacoes-quimicas-dos-alimentos https://cejarj.cecierj.edu.br/pdf/Unidade02_Qui.pdf SAIBA MAIS… Assista ao vídeo transformações
químicas e físicas disponível em https://youtu.be/Aa_iIwk4T7w
|